2 Minuten
Knapp 100 Jahre nach der Entdeckung des Insulins konnte ein deutsch-amerikanisches Forscherteam zeigen, wie genau das Hormon seinen Rezeptor aktiviert und damit ein lange bestehendes Rätsel lösen.
Das Hormon Insulin steuert sowohl den Stoffwechsel als auch das Wachstum. Ist diese Funktion gestört, kann das zu schweren Krankheiten wie Diabetes mellitus oder Krebs führen. Die biologischen Wirkungen des Hormons werden durch ein passendes Protein auf der Zelloberfläche vermittelt – den Insulinrezeptor.
In einer aktuellen Studie konnten Forscher des Paul-Langerhans-Instituts Dresden und der New Yorker Rockefeller University nun aufklären, wie der Rezeptor reagiert, sobald das Insulin an ihn an der Zelloberfläche bindet. Bisher war bekannt, dass Insulin außen an der Zelle bindet und die Form des Rezeptors auf der Innenseite sich daraufhin verändert, um das Signal weiterzugeben. Die Art der Strukturänderung blieb jedoch jahrzehntelang ein Rätsel, was dazu führte, dass widersprüchliche Modelle für die Aktivierung des Insulinrezeptors aufgestellt wurden.
“Um Einblicke in die Rezeptoraktivierung zu erhalten, haben wir vollständige, humane Insulinrezeptoren aufgereinigt und diese in sogenannte Nanodiscs eingebettet. Das sind wenige Nanometer große scheibenförmige Miniaturmembranen, welche dann direkt unter dem Elektronenmikroskop sichtbar gemacht werden konnten“, erklärt Doktorandin Theresia Gutmann, Co-Erstautorin der Studie.
Sie arbeitet am Institut für Pankreatische Inselzellforschung/Paul Langerhans Institut Dresden (IPI/PLID), welches zusammen vom Helmholtz Zentrum München mit dem Universitätsklinikum Carl Gustav Carus der Technischen Universität in Dresden betrieben wird.
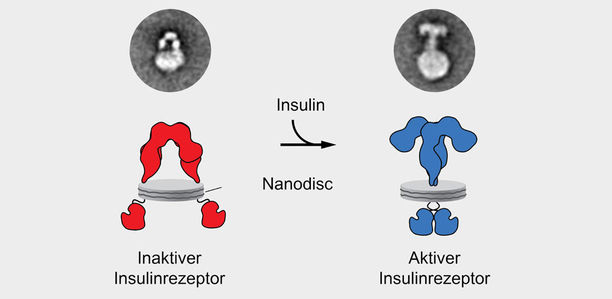
“Durch die Nanodisc-Technologie konnten wir also den Insulinrezeptor in einer künstlichen Membran direkt beobachten”, erklärt Dr. Ünal Coskun, Gruppenleiter am IPI/PLID und Co-Seniorautor der Studie. “In Abwesenheit von Insulin weist der Rezeptor die Gestalt eines umgekehrten “U” auf und hält so die beiden Enden voneinander getrennt. Allerdings müssen genau diesen beiden Enden – sogenannte Kinasedomänen – für die Signalweitergabe zusammengeführt werden.“
„Bindet nun aber das Insulin, erfolgt eine dramatische Reorganisation und der Rezeptor nimmt eine T-förmige Struktur an, wodurch sich die Kinasedomänen berühren und sehr wahrscheinlich die Signalübertragung auslösen“, führt Dr. Thomas Walz, Professor an der Rockefeller University, weiter aus (Schema: siehe Bild oben).
Dr. Coskun ordnet die Studie ein: „Die in Nanodiscs eingebetteten Rezeptoren bieten eine vollkommen neue Möglichkeit, um weitere Fragen bezüglich der Insulinrezeptoraktivierung zu beantworten und potentiell therapeutische Wirkstoffe in definierten Umgebungen zu untersuchen.“
„Unsere Ergebnisse zeigen direkt die strukturellen Änderungen im vollständigen Rezeptor bei Insulinbindung und bieten eine Antwort auf die seit langem bestehende Frage nach dem Mechanismus, mit dem Insulin seinen Rezeptor aktiviert ”, so Co-Erstautorin Gutmann abschließend. Die Wissenschaftler aus Dresden sind Teil des Deutschen Zentrums für Diabetesforschung, kurz DZD.
Die Studien-Ergebnisse und Bilder veröffentlichten die Wissenschaftlerinnen und Wissenschaftler im Journal of Cell Biology.
Quelle: Pressemitteilung des Helmholtz Zentrum München – Deutsches Forschungszentrum für Gesundheit und Umwelt

5 Minuten
Geschichten, Gemeinschaft, Gesundheit: Der Diabetes-Anker ist das neue Angebot für alle Menschen mit Diabetes – live, gedruckt und digital. Der Diabetes-Anker und die Community sind immer da, wo du sie brauchst. Für alle Höhen und Tiefen.
Alle wichtigen Infos und Events für Menschen mit Diabetes – kostenlos und direkt in deinem Postfach. Mit unserem Newsletter verpasst du nichts mehr.
Beliebte Themen
Ernährung
Aus der Community
Push-Benachrichtigungen
